コセルゴ®カプセルは、2025年に19歳以上の患者への投与や食事前後の投与が可能となりました。 薬剤の最新情報は電子添文をご参照ください。
- コセルゴ®は、カプセルと顆粒があり、本動画ではカプセルの内容が紹介されています。
コセルゴ®(カプセル)製品紹介動画
コセルゴ®の基本情報や日本人を含む臨床試験データをご紹介しています。
※下部に本動画のスライドと解説を載せています。ご参照ください。
再生バーのマークをクリックすると、各チャプターへ移動できます。
- 0:00~
- オープニング
- 0:10~
- コセルゴの変遷
- 0:37~
- NF1と叢状神経線維腫
- 2:13~
- コセルゴについて
小児期(3~18歳)の臨床試験
- 2:44~
- 国内第Ⅰ相試験(試験デザイン・患者背景)
- 3:45~
- 国内第Ⅰ相試験(安全性)
- 4:20~
- 国内第Ⅰ相試験(有効性)
成人期(18歳以上)の臨床試験
- 4:44~
- 国際共同第Ⅲ相試験(試験デザイン・患者背景)
- 6:26~
- 国際共同第Ⅲ相試験(有効性)
- 8:02~
- 国際共同第Ⅲ相試験(安全性)
- 8:56~
- 適正患者
※PCでご覧の方は、クリックでスライドと解説を拡大できます
オープニング
本動画では、日本人を含む臨床試験データを中心に、「コセルゴ®(以下、コセルゴ)」についてご紹介いたします。
コセルゴの変遷
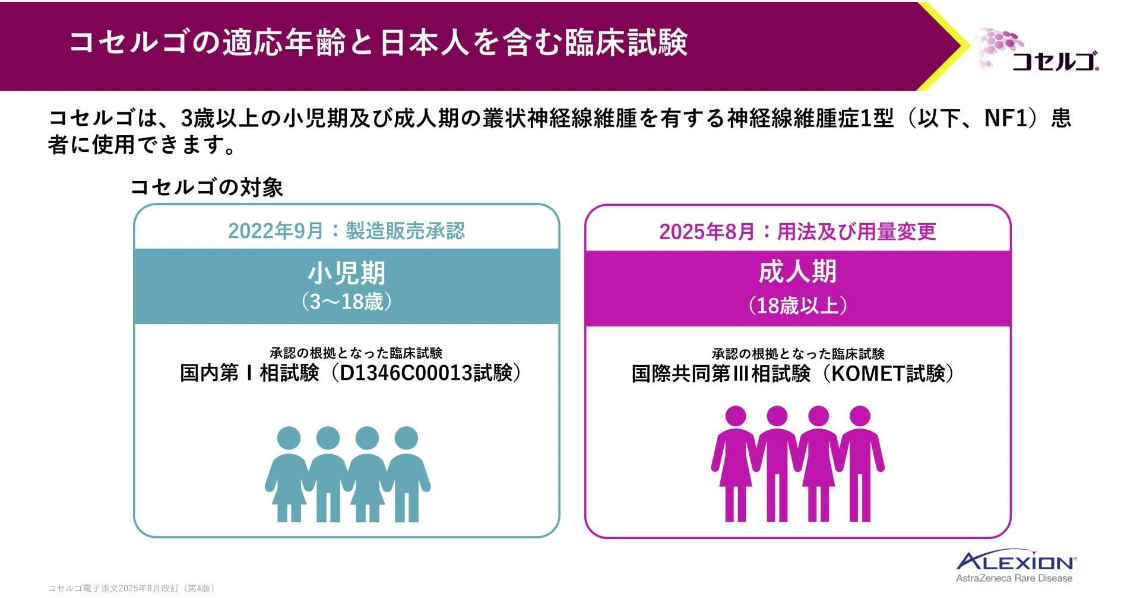
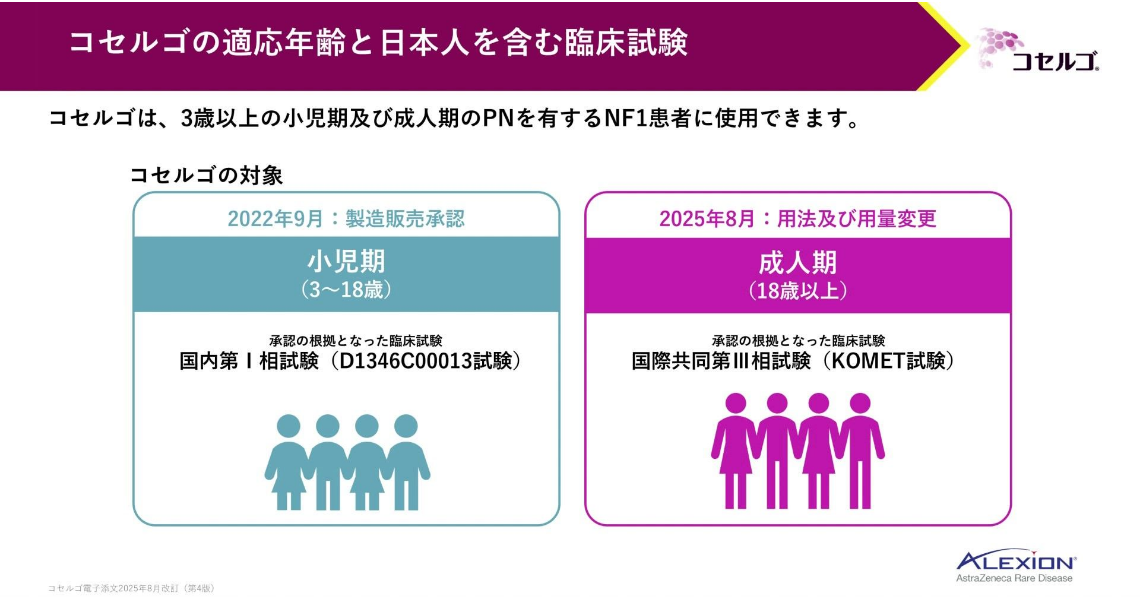
コセルゴは、2022年に小児期(3~18歳)の患者への適応が承認されたMEK1/2阻害剤です。さらに、2025年には成人期を含めた用法及び用量への変更が承認され、症候性かつ手術で完全に切除できない叢状神経線維腫を有する19歳以上の神経線維腫症1型(以下、NF1)患者にも使用できるようになりました。
NF1と叢状神経線維腫
臨床試験をご紹介する前に、まずはコセルゴの適応疾患について整理いたします。
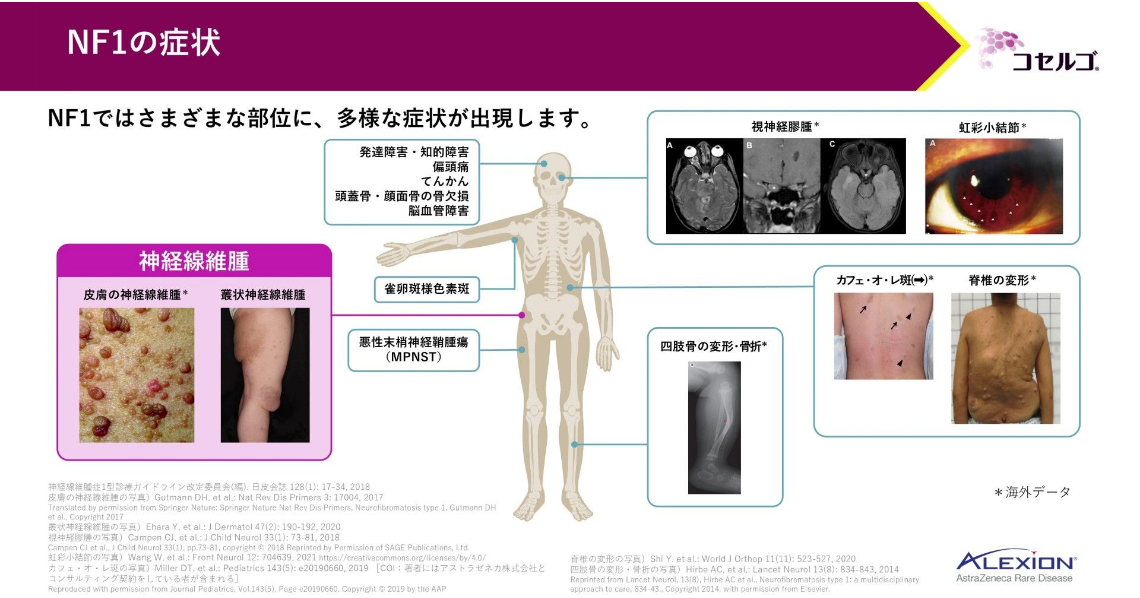
NF1は、さまざまな部位に多様な症状が出現する疾患です。カフェ・オ・レ斑等の皮膚症状のみならず、骨の変形や腫瘍性病変が認められることもあります。
これらの症状のうち、NF1に特徴的なものの1つが神経線維腫です。
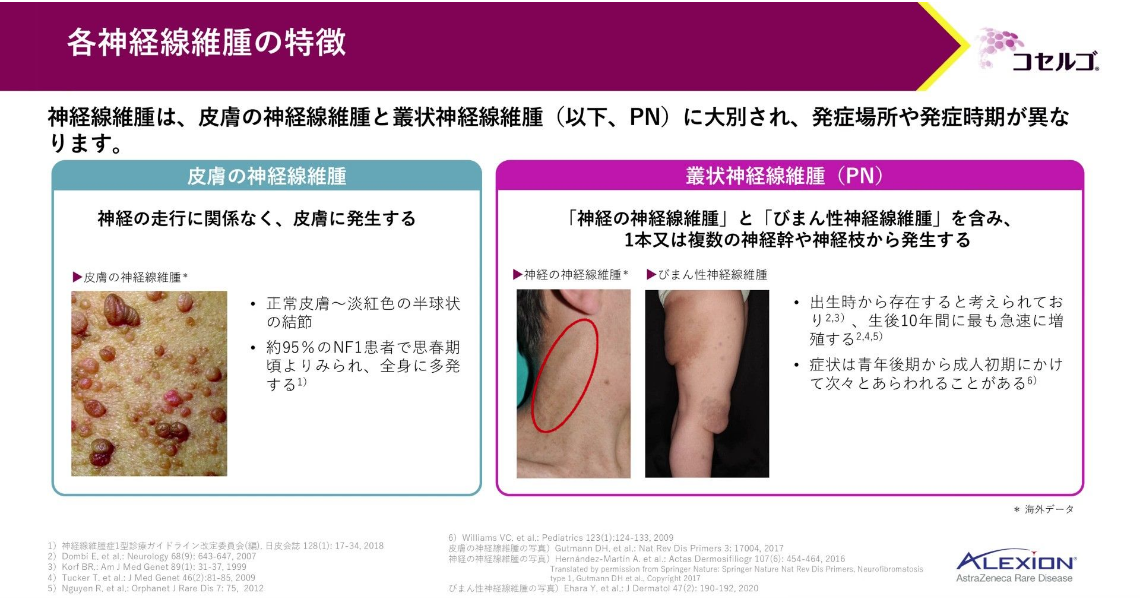
神経線維腫は2つに大別されます。
皮膚の神経線維腫は、皮膚に発生し、思春期頃から徐々に見られるようになります。
一方、叢状神経線維腫は、皮膚より深い部位で、1本又は複数の神経幹や神経枝から発生します。出生時から存在すると考えられていますが、症状は成人後に出現することもあり、その時点で初めて腫瘍に気づくこともあります。
叢状神経線維腫の臨床課題として、痛みといった神経症状等さまざまな症候の出現や、ADL・QOLへの影響があります。また、予後不良な悪性末梢神経鞘腫瘍(MPNST)に悪性化するリスクがあるため切除が望まれますが、完全切除が困難な症例や、部分切除後に再発を認める症例も少なくありません。
このような背景から、積極的な経過観察を行い悪性化を見逃さないこと、症候の改善やADL・QOL向上を目指すことが求められています。
コセルゴについて
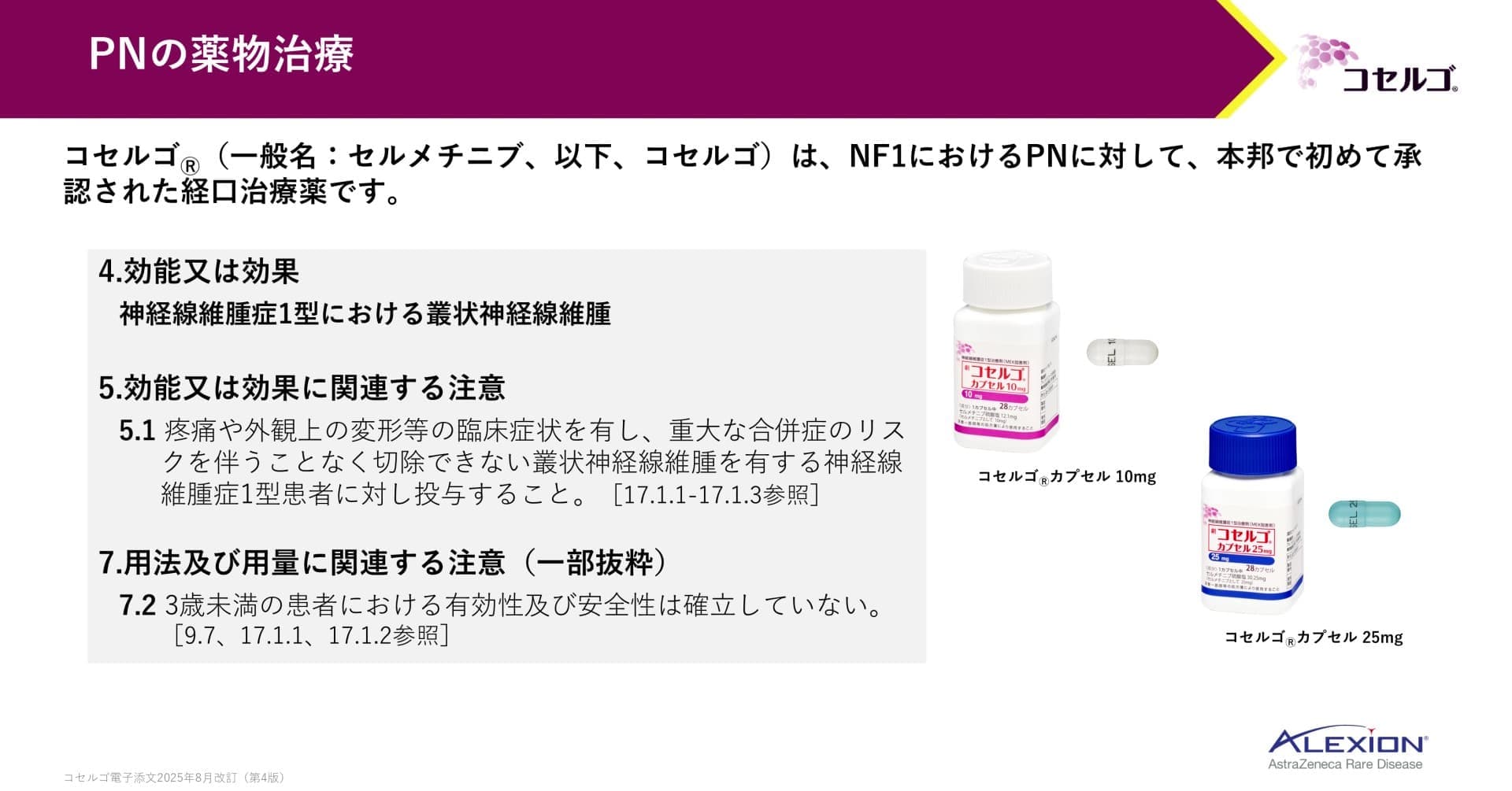
コセルゴは、NF1における叢状神経線維腫の増殖を抑制する、本邦で初めて承認された経口治療薬です。
承認の根拠となった日本人を含む臨床試験として、小児期は国内第Ⅰ相試験、成人期は国際共同第Ⅲ相試験(KOMET試験)が行われました。
ここからは、この2つの臨床試験についてご紹介いたします。まずは、国内第Ⅰ相試験です。
小児期(3~18歳)の臨床試験
国内第Ⅰ相試験(試験デザイン・患者背景)
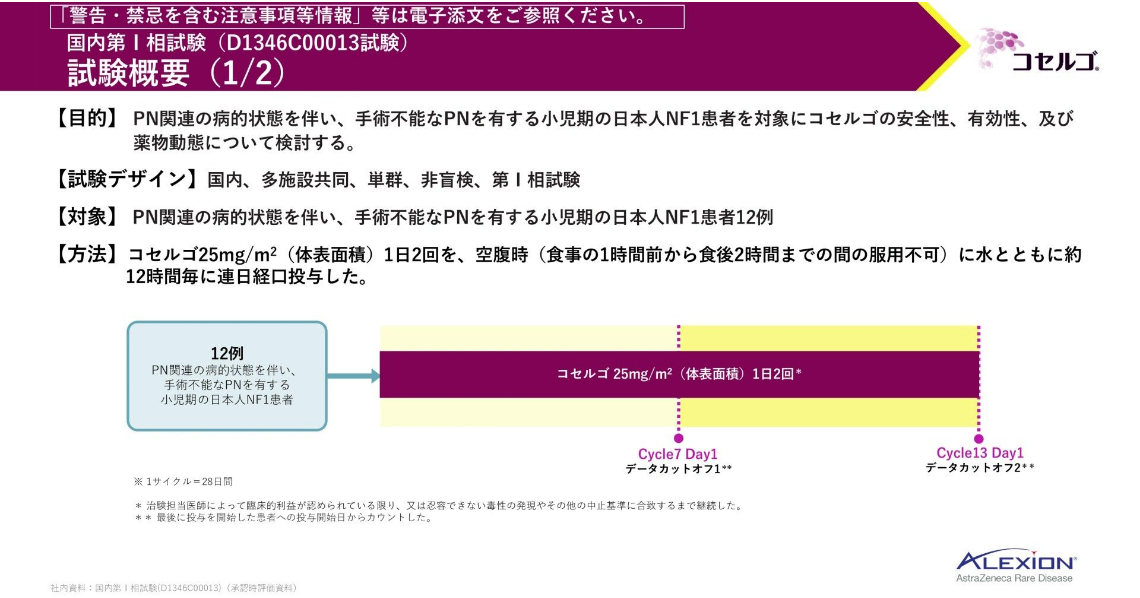
国内第Ⅰ相試験は3~18歳を対象とした単群・非盲検・多施設共同の臨床試験です。
病的状態を伴い、手術不能な叢状神経線維腫を有する日本人NF1患者に、コセルゴを投与したときの安全性・有効性・薬物動態を検討する目的で実施されました。
主要評価項目は安全性、副次評価項目は客観的奏効率(以下、ORR)、全般的評価等でした。
解析計画は、こちらに記載の通りです。
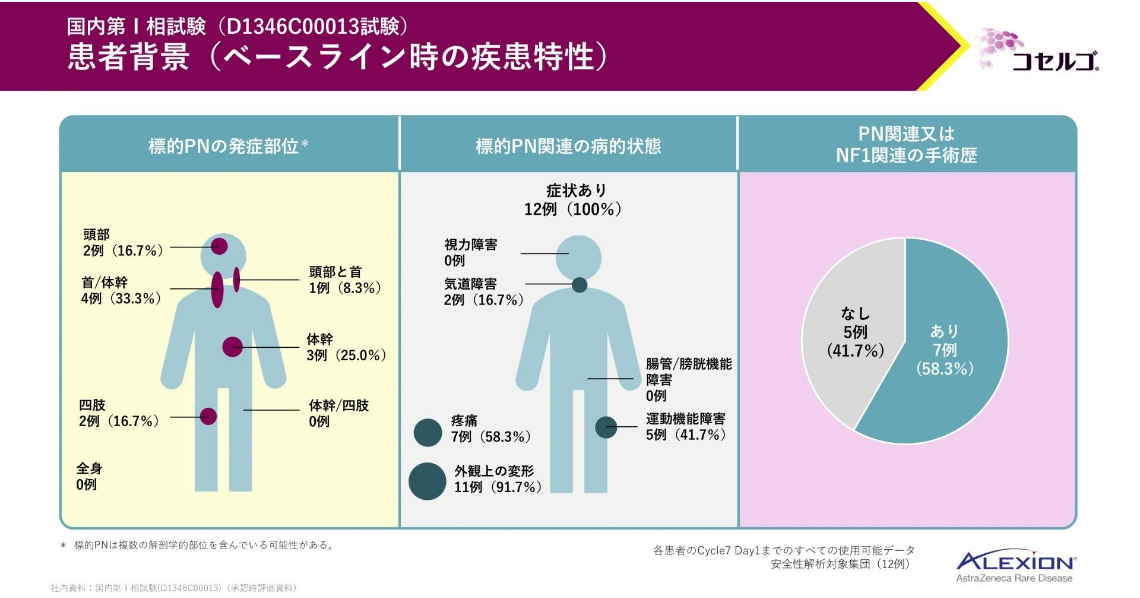
患者背景です。
組み入れられた患者の年齢の平均値は約13歳でした。
標的とする叢状神経線維腫関連の病的状態として、外観上の変形が91.7%、疼痛が58.3%に認められました。
小児期(3~18歳)の臨床試験
国内第Ⅰ相試験(安全性)
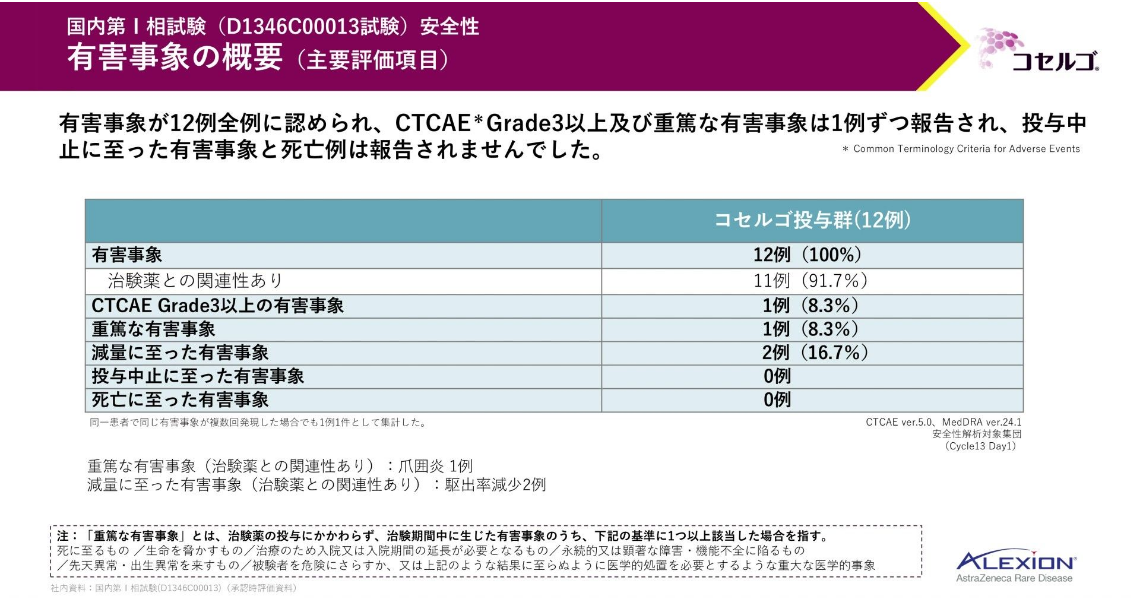
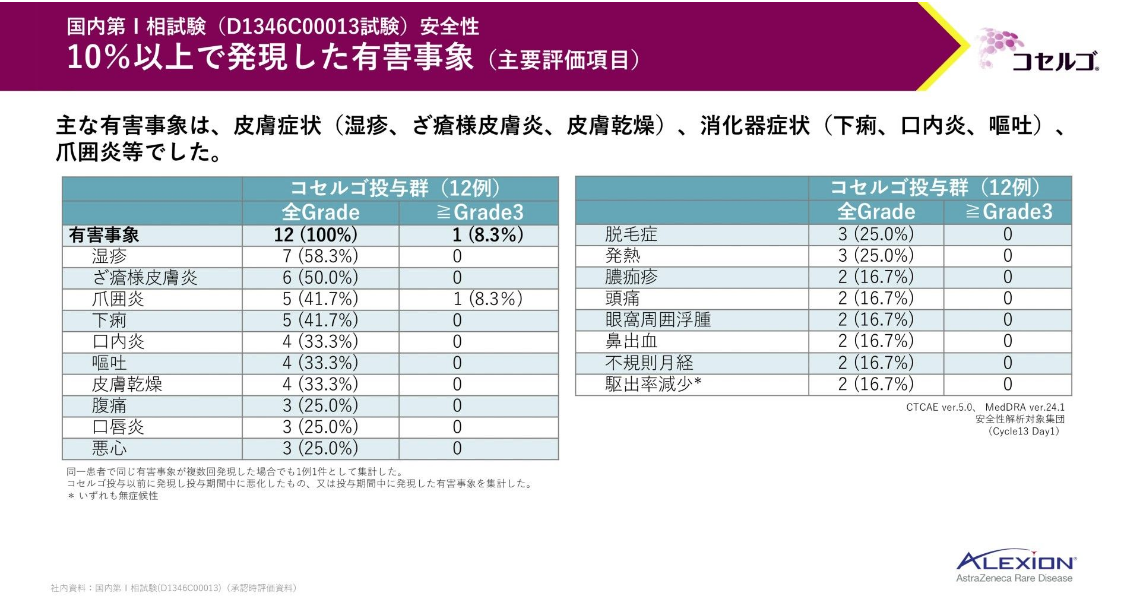
主要評価項目である安全性のデータをお示しします。
有害事象が全例に、重篤な有害事象が8.3%に認められました。投与中止に至った有害事象、死亡に至った有害事象は認められませんでした。
こちらは、10%以上の発現率を示した有害事象一覧です。
主な有害事象は、湿疹、ざ瘡様皮膚炎等の皮膚症状、下痢等の消化器症状、爪囲炎等でした。
小児期(3~18歳)の臨床試験
国内第Ⅰ相試験(有効性)
次は、副次評価項目です。
Cycle13 Day1の約1年時点において、ORRは33.3%でした。
副次評価項目である全般的評価はGICで評価され、66.7%の患者が軽度改善以上(「著明改善」、「中等度改善」、「軽度改善」のいずれか)と判断されました。
成人期(18歳以上)の臨床試験
国際共同第Ⅲ相試験(試験デザイン・患者背景)
続いては、成人期の患者を対象とした国際共同第Ⅲ相試験であるKOMET試験についてご紹介します。
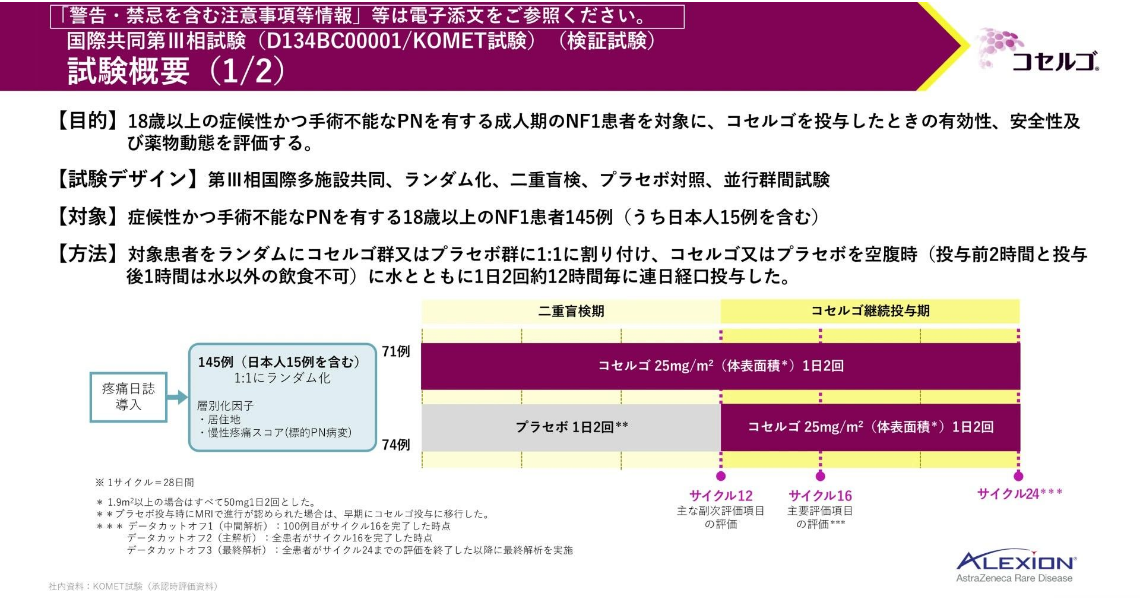
KOMET試験は、症候性かつ手術不能な叢状神経線維腫を有する成人期のNF1患者に対して、MEK1/2阻害剤を投与した、初めての国際共同・ランダム化・プラセボ対照の第Ⅲ相試験です1)。
対象患者を、コセルゴ群又はプラセボ群に無作為に割り付け、二重盲検下で評価を実施しました。
なお、層別化因子として、居住地と慢性疼痛スコアが設定されていました。
- Chen AP. et al.: Lancet 405(10496): 2217-2230, 2025
[COI:本研究は、アストラゼネカ株式会社より資金提供を受けた。アストラゼネカ株式会社は、試験デザイン等にも 関与した。著者の中には、 Alexion, AstraZeneca Rare Diseaseの社員や株主、 Alexion, AstraZeneca Rare Disease又はアストラゼネカ株式会社より諮問委員会の報酬やコンサルタント料、講演料、謝礼金等を受領している者が含まれる]
試験概要はお示しの通りで、主要評価項目はORR、主な副次評価項目は慢性疼痛強度スコア(叢状神経線維腫の疼痛強度尺度[以下、PAINS-pNF]による標的PN病変慢性疼痛強度スコア)及びQOL(叢状神経線維腫のQoL尺度[PlexiQoL])の総スコアの変化量、その他の副次評価項目は安全性等でした。
解析計画は、こちらに記載の通りです。
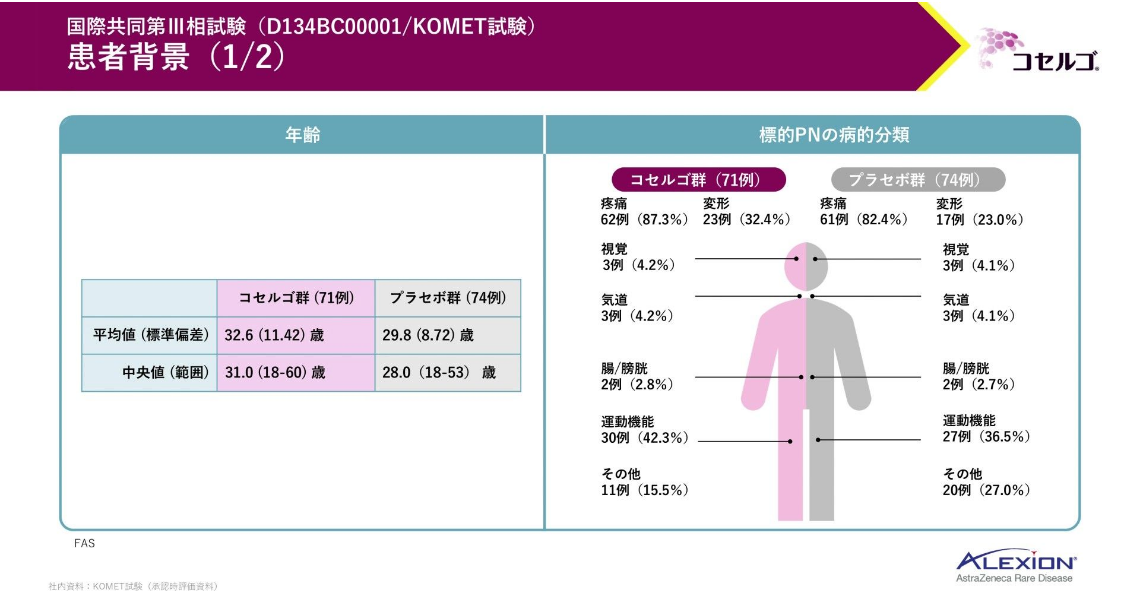
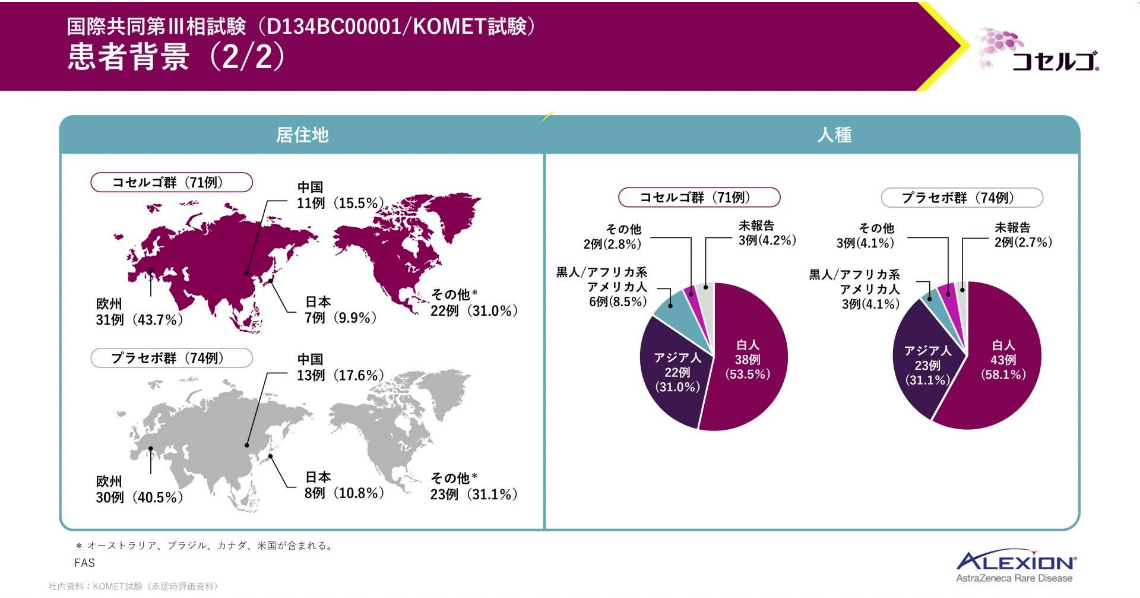
患者背景です。
標的とする叢状神経線維腫の病的分類は、コセルゴ群とプラセボ群でそれぞれ疼痛が87.3%、82.4%、運動機能が42.3%、36.5%、変形が32.4%、23.0%でした。
組み入れた患者はいずれの群も白人、次いでアジア人の順に多く、日本人も15例登録されています。
成人期(18歳以上)の臨床試験
国際共同第Ⅲ相試験(有効性)
主要評価項目であるORRの結果をお示しします。
コセルゴ群が19.7%、プラセボ群が5.4%、群間差は14.3%であり、コセルゴ群とプラセボ群の間に統計学的に有意な差が認められました。
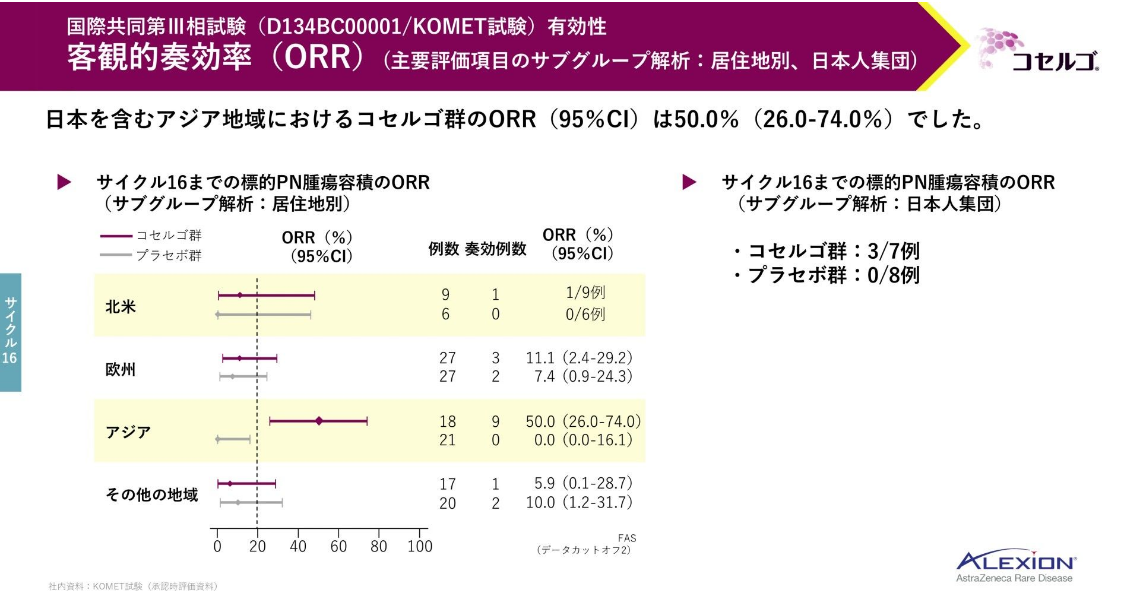
居住地別のサブグループ解析では、日本人を含むアジア地域におけるコセルゴ群のORRは50%でした。
日本人集団において、コセルゴ群の7例中3例が客観的奏効を達成し、プラセボ群で奏効を示した患者はいませんでした。
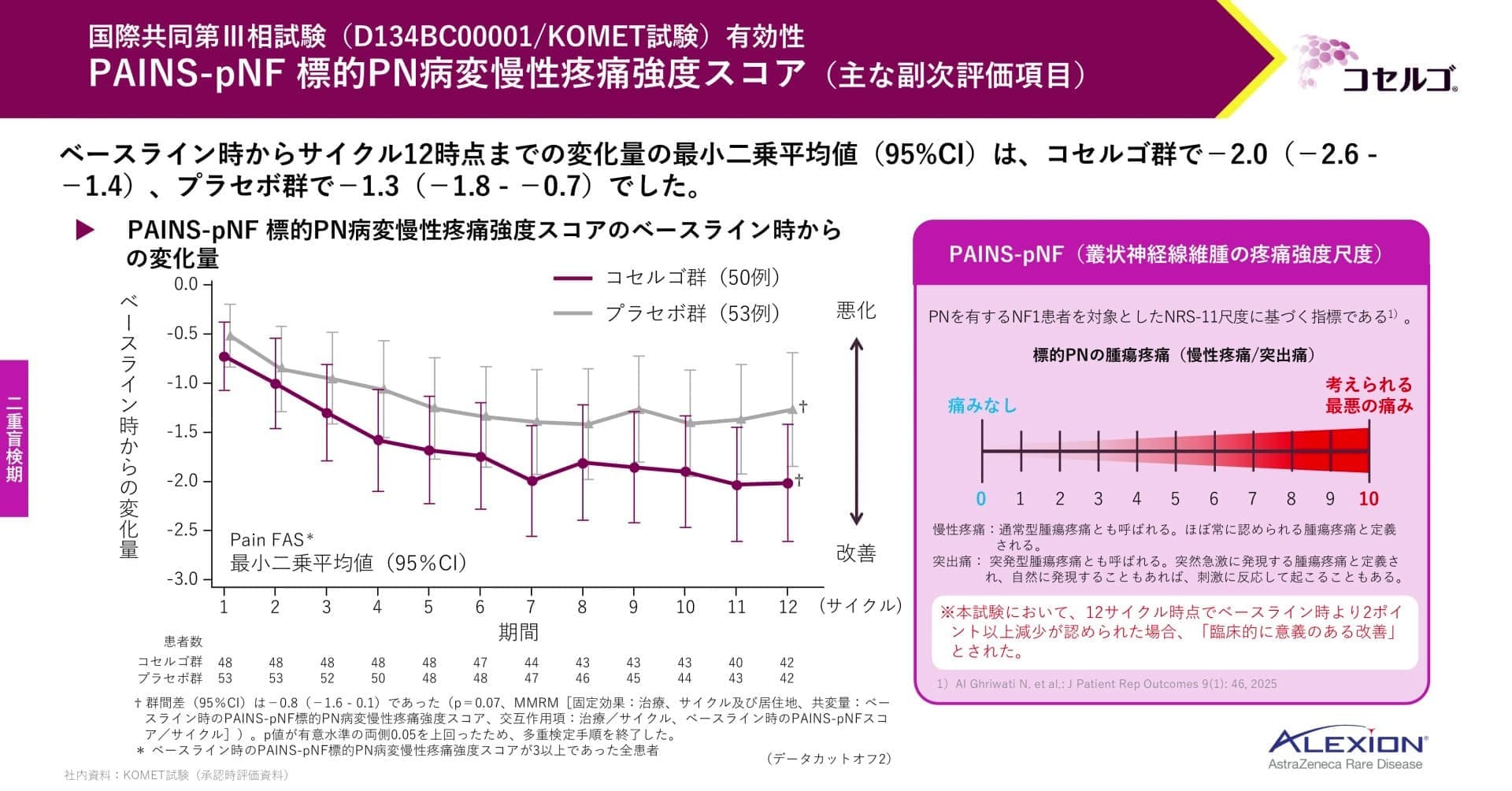
主な副次評価項目である慢性疼痛強度スコア(PAINS-pNF標的PN病変慢性疼痛強度スコア)の結果です。NRS-11尺度に基づく指標が使われており、数値が下がるほど痛みが減ったと解釈します。
本試験では、サイクル12時点で最小二乗平均値がベースライン時より2ポイント以上減少した場合を臨床的に意義のある改善としました。
ベースライン時からサイクル12時点までの変化量の最小二乗平均値は、コセルゴ群でー2.0、プラセボ群でー1.3でした。
同じNRS-11尺度で日本人集団を評価すると、コセルゴ群で-3.362、プラセボ群でー1.158でした(サブグループ解析)。
成人期(18歳以上)の臨床試験
国際共同第Ⅲ相試験(安全性)
続いて、安全性のデータです。
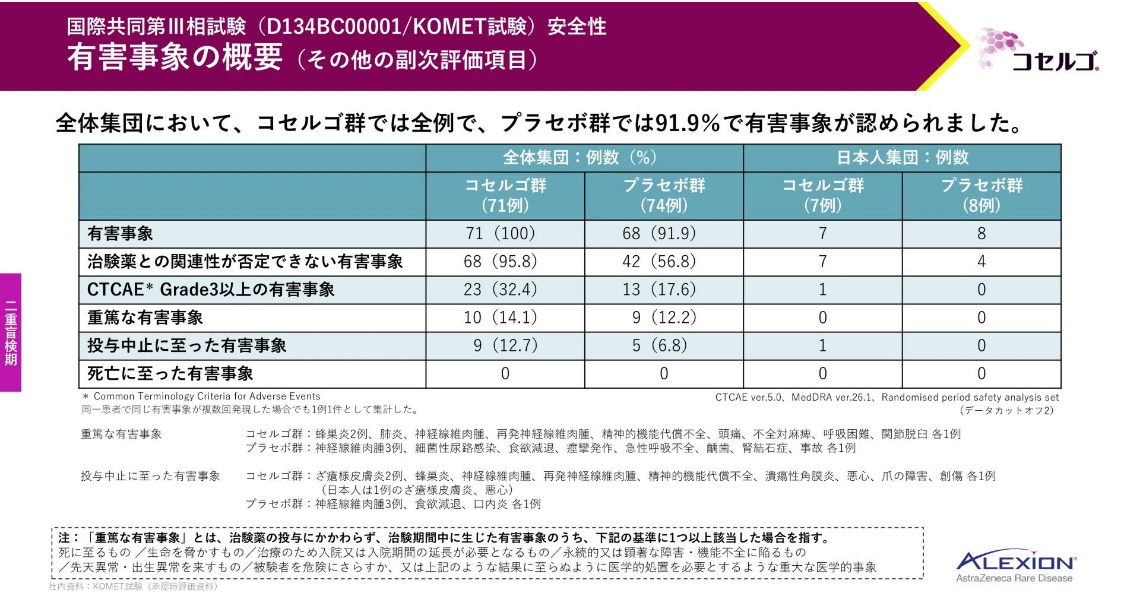
コセルゴ群では全例で、プラセボ群では91.9%に有害事象が認められました。
重篤な有害事象はコセルゴ群では14.1%、プラセボ群では12.2%、投与中止に至った有害事象はコセルゴ群では12.7%、プラセボ群では6.8%に認められました。
いずれの群でも死亡に至った有害事象は認められませんでした。
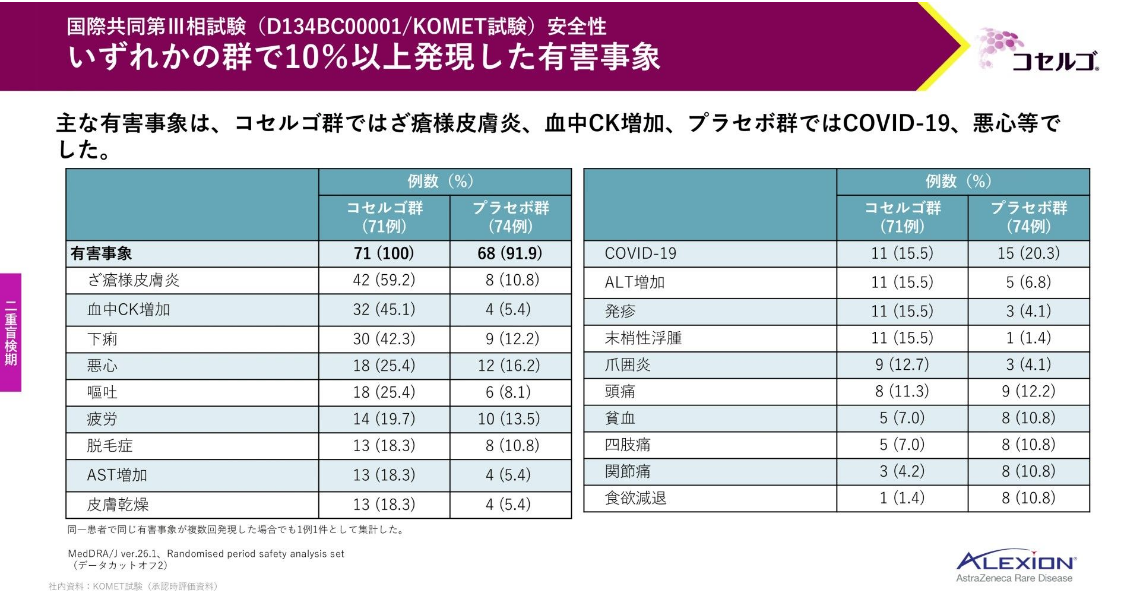
こちらは、いずれかの群で10%以上発現した有害事象一覧です。
コセルゴ群ではざ瘡様皮膚炎や血中CK(クレアチンキナーゼ)増加、プラセボ群ではCOVID-19や悪心等が認められました。
臨床試験データは以上です。
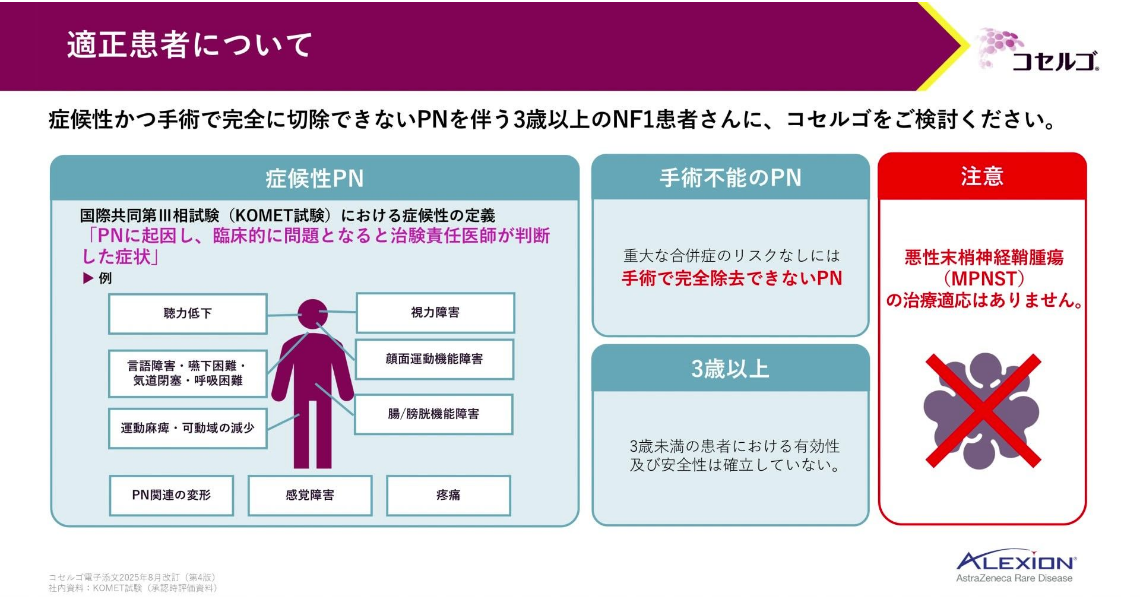
適正患者
最後に、適正患者について整理します。
コセルゴは、症候性かつ手術で完全に切除できない叢状神経線維腫を有する3歳以上のNF1患者に使用できます。
症候性には、変形等の整容的な問題や、視力障害・運動麻痺等の機能的な問題が含まれます。
なお、MPNSTの治療には適応がありませんので、ご注意ください。
該当する患者さんがいらっしゃいましたら、本動画の内容も参考に投与をご検討ください。