コセルゴ®における注意事項、異常がみられた場合の対処方法1)
本剤の投与により、消化管障害があらわれる場合があるので、次の事項に注意してください。
- 小児を対象とした臨床試験において、嘔吐、下痢、悪心等の消化管障害が認められています。
- 既承認のMEK阻害剤において、嘔吐、下痢、悪心等の消化管関連事象の発現が報告されています。
<異常がみられた場合の対処方法>
- 必要に応じて休薬、減量や投与中止等、適切な処置を行ってください。
- 厚生労働省のホームページに重篤副作用疾患別対応マニュアル「重度の下痢」が掲載されていますのでご参照ください。
https://www.mhlw.go.jp/topics/2006/11/tp1122-1g.html(2024/02/09確認)
具体的な推奨
欧州の医師によるコンセンサスベースの推奨事項をご紹介いたします2)。
コンセンサス85%
悪心、下痢、便秘の対処のために、患者は揚げ物や脂質・塩分の高い食品を避けるべきである。また、可能であれば栄養士と相談する。
- このような食事の推奨は、人によっては当たり前でも、すべての患者及び介護者が同じように理解しているとは限らないため、効果的なコミュニケーションが必要となる。
- 過剰と受け取られ、コンプライアンス低下につながる可能性があるため、一般的によいと考えられる食事から逸脱するほど厳格な食事制限をしてはならない。
- 心理士は、食事に関する推奨事項を守るように子どもの意欲を引き出し、コンプライアンス低下を防ぐために介護者を支援することができる。
コンセンサス85%
胃炎による悪心や嘔吐に対して治療が必要な場合は、プロトンポンプ阻害剤(オメプラゾールを除く)を使用すべきである。
- 胃炎は、臨床経過や症状から疑い、内視鏡検査で確定することができる。
- オメプラゾールはCYP2C19阻害剤であり、セルメチニブの血漿中濃度を上昇させる可能性があるため、使用を避けるべきである。
- 悪心や嘔吐が再発する場合は、治療選択において消化器専門医の意見が必要な場合がある。
コンセンサス85%
悪心や嘔吐に食事変更だけで対処できなければ、制吐剤を使用することができる。
患者の悪心や嘔吐が重篤な場合にのみ、制吐剤を使用すべきである。使用する場合、治療が有効か評価するために、患者は制吐剤を2~3週間試してもよい。
コンセンサス100%
口内炎による疼痛を抑えるために、口内炎用のジェルを使用することができる。
口内炎用のジェルは、症状を伴う場合に使用すべきである。
口内炎用ジェルの例:リドカイン塩酸塩2%(経口)
コンセンサス100%
口内炎予防のために、患者は1日2回の歯磨き、舌のブラッシング、少なくとも3か月に1回の歯ブラシの交換といった口腔ケアレジメンに従うことが推奨される。
- 歯ブラシは柔らかいものを使用すべきである(例:フィンガーブラシ)。
- 幼児の場合、毎日きちんと歯磨きができないという問題が起こりうるため、心理士は子どものやる気を引き出し、歯磨きを管理しやすくする方法について介護者に助言すべきである。
- 消毒薬入りの口腔洗浄剤や生理食塩水、炭酸水素ナトリウムによる定期的な洗口も適切な予防行動である。
- 歯科的な問題は口腔内の外傷につながる可能性があるため、上記以外にも患者は定期的なフロスの使用といった好ましい歯科的ケアのレジメンに従うべきである。
コンセンサス100%
患者及び医療関係者は、定期的に口腔内を検査し、口内炎の有無を確認する必要がある。
- 各薬剤や対処法の詳細は、それぞれの電子添文等をご参照ください。
- コセルゴ適正使用ガイド(2024年3月作成)p21
- Azizi AA. et al.: Neurooncol Pract 11(5): 515-531, 2024[COI:本研究は、アレクシオンファーマ合同会社の支援により実施され、編集助手はAlexion AstraZeneca Rare Diseaseより資金提供を受けている。著者の中には、アレクシオンファーマ合同会社及びアストラゼネカ株式会社の諮問委員会のメンバーや講演会の謝礼金、渡航費、研究助成費を受領している者が含まれる]
Azizi AA. et al., Consensus recommendations on management of selumetinib-associated adverse events in pediatric patients with neurofibromatosis type 1 and plexiform neurofibromas, Neurooncol Pract, 2024, 11(5), 515-531, by permission of Oxford University Press
下痢、及び下痢以外の消化器障害時の用量調節基準1)
下痢の場合


- GradeはCTCAE ver.4.03に準じる
下痢以外の消化管障害の場合


- GradeはCTCAE ver.4.03に準じる
消化器障害のGrade分類(一部)
嘔吐のGrade分類(CTCAE v4.0 - JCOGより抜粋)2)
| Grade1 | Grade2 | Grade3 | Grade4 |
|---|---|---|---|
| 24時間に1-2エピソードの嘔吐(5分以上間隔が開いたものをそれぞれ1エピソードとする) | 24時間に3-5エピソードの嘔吐(5分以上間隔が開いたものをそれぞれ1エピソードとする) | 24時間に6エピソード以上の嘔吐(5分以上間隔が開いたものをそれぞれ1エピソードとする);TPN又は入院を要する | 生命を脅かす;緊急処置を要する |
嘔吐のGrade分類(CTCAE v5.0 - JCOGより抜粋)3)
| Grade1 | Grade2 | Grade3 | Grade4 |
|---|---|---|---|
| 治療を要さない | 外来での静脈内輸液を要する;内科的治療を要する | 経管栄養/TPN/入院を要する | 生命を脅かす |
下痢のGrade分類(CTCAE v4.0 - JCOGより抜粋)2)
| Grade1 | Grade2 | Grade3 | Grade4 |
|---|---|---|---|
| ベースラインと比べて<4回/日の排便回数増加;ベースラインと比べて人工肛門からの排泄量が軽度に増加 | ベースラインと比べて4-6回/日の排便回数増加;ベースラインと比べて人工肛門からの排泄量が中等度増加 | ベースラインと比べて7回以上/日の排便回数増加;便失禁;入院を要する;ベースラインと比べて人工肛門からの排泄量が高度に増加;身の回りの日常生活動作の制限 | 生命を脅かす;緊急処置を要する |
下痢のGrade分類(CTCAE v5.0 - JCOGより抜粋)3)
| Grade1 | Grade2 | Grade3 | Grade4 |
|---|---|---|---|
| ベースラインと比べて<4回/日の排便回数増加;ベースラインと比べて人工肛門からの排泄量が軽度に増加 | ベースラインと比べて4-6回/日の排便回数増加;ベースラインと比べて人工肛門からの排泄量の中等度増加;身の回り以外の日常生活動作の制限 | ベースラインと比べて7回以上/日の排便回数増加;入院を要する;ベースラインと比べて人工肛門からの排泄量の高度増加;身の回りの日常生活動作の制限 | 生命を脅かす;緊急処置を要する |
悪心のGrade分類(CTCAE v4.0 - JCOGより抜粋)2)
| Grade1 | Grade2 | Grade3 | Grade4 |
|---|---|---|---|
| 摂食習慣に影響のない食欲低下 | 顕著な体重減少、脱水又は栄養失調を伴わない経口摂取量の減少 | カロリーや水分の経口摂取が不十分;経管栄養/TPN/入院を要する | - |
悪心のGrade分類(CTCAE v5.0 - JCOGより抜粋)3)
| Grade1 | Grade2 | Grade3 | Grade4 |
|---|---|---|---|
| 摂食習慣に影響のない食欲低下 | 顕著な体重減少、脱水又は栄養失調を伴わない経口摂取量の減少 | カロリーや水分の経口摂取が不十分;経管栄養/TPN/入院を要する | - |
口内炎のGrade分類(CTCAE v4.0 - JCOG[口腔粘膜炎]より抜粋)2)
| Grade1 | Grade2 | Grade3 | Grade4 |
|---|---|---|---|
| 症状がない、又は軽度の症状がある;治療を要さない | 中等度の疼痛;経口摂取に支障がない;食事の変更を要する | 高度の疼痛;経口摂取に支障がある | 生命を脅かす;緊急処置を要する |
口内炎のGrade分類(CTCAE v5.0 - JCOG[口腔粘膜炎]より抜粋) 3)
| Grade1 | Grade2 | Grade3 | Grade4 |
|---|---|---|---|
| 症状がない、又は軽度の症状;治療を要さない | 経口摂取に支障がない中等度の疼痛又は潰瘍;食事の変更を要する | 高度の疼痛;経口摂取に支障がある | 生命を脅かす;緊急処置を要する |
- コセルゴ電子添文2023年12月改訂(第3版)
- JCOGホームページ: Common Terminology Criteria for Adverse Events(CTCAE)Version 4.0, https://jcog.jp/assets/CTCAEv4J_20170912_v20_1.pdf, 2024/08/06確認
- JCOGホームページ: Common Terminology Criteria for Adverse Events(CTCAE)Version 5.0, https://jcog.jp/assets/CTCAEv5J_20220901_v25_1.pdf, 2024/08/06確認
臨床試験での初回発現時期
海外第Ⅱ相試験における嘔吐、下痢、悪心、口内炎の初回発現時期は図の通りでした(海外データ)1)。
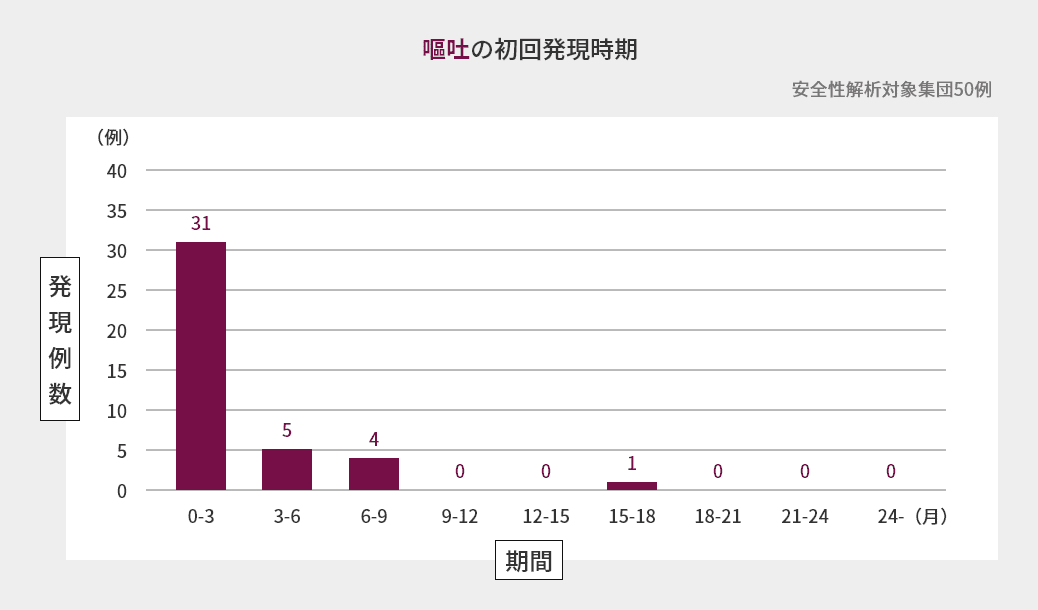
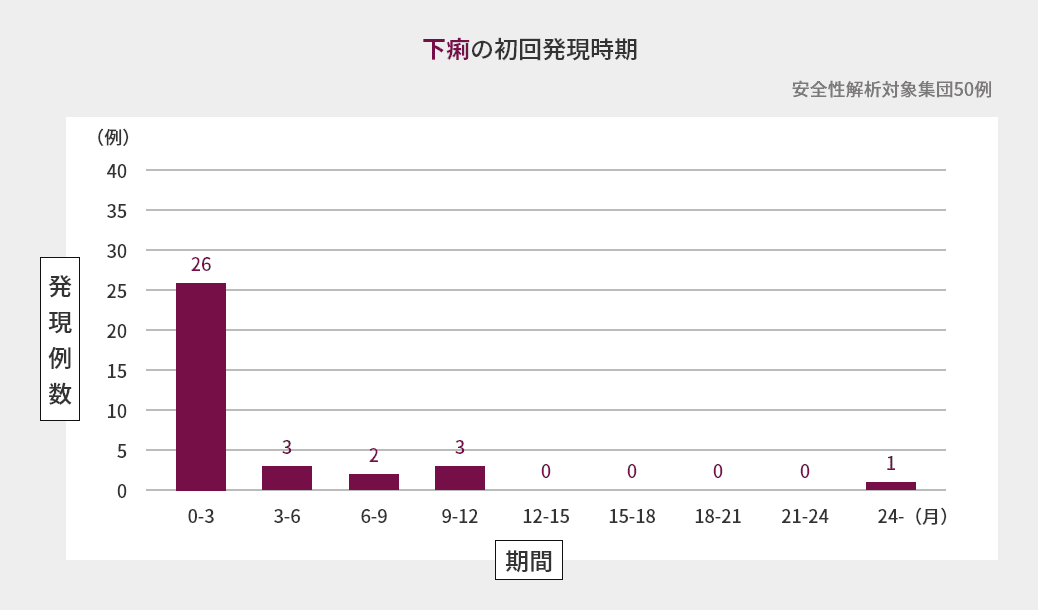
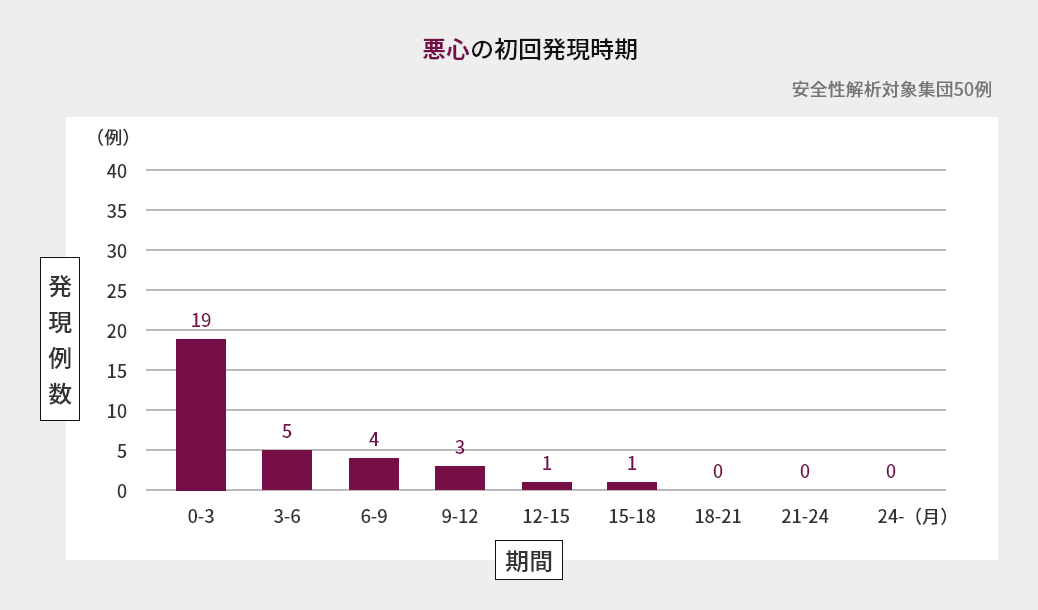
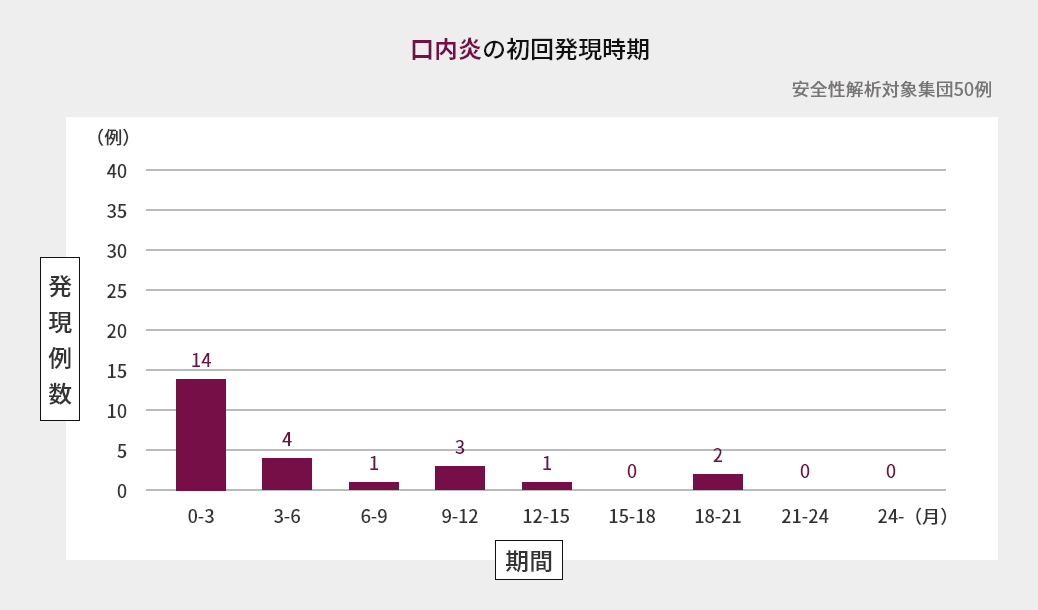
臨床試験での発現状況(海外データを含む)2)3)
臨床試験での有害事象の発現状況(海外第Ⅱ相試験、国内第Ⅰ相試験、海外第Ⅰ相試験群と海外第Ⅱ相試験群の併合集団)
- 海外第Ⅱ相試験、国内第Ⅰ相試験、及び小児患者の併合集団において、本剤が投与された患者における消化管障害の発現状況は以下の通りでした。
| 試験 | 全Grade 例(%) |
Grade3以上 例(%) |
||||||
|---|---|---|---|---|---|---|---|---|
| 嘔吐 | 下痢 | 悪心 | 口内炎 | 嘔吐 | 下痢 | 悪心 | 口内炎 | |
| 海外第II相試験 50例 |
43 (86.0) |
37 (74.0) |
36 (72.0) |
26 (52.0) |
4 (8.0) |
8 (16.0) |
2 (4.0) |
0 (0.0) |
| 国内第I相試験 12例 |
4 (33.3) |
5 (41.7) |
3 (25.0) |
4 (33.3) |
0 (0.0) |
0 (0.0) |
0 (0.0) |
0 (0.0) |
| 小児患者の併合集団 (海外第Ⅰ相試験群+海外第Ⅱ相試験群) 74例 |
64 (86.5) |
60 (81.1) |
57 (77.0) |
41 (55.4) |
7 (9.5) |
11 (14.9) |
2 (2.7) |
1 (1.4) |
Gradeは海外第Ⅰ相試験及び海外第Ⅱ相試験ではCTCAE ver.4.0に、国内第Ⅰ相試験ではCTCAE ver.5.0に準じる。
- 小児患者の併合集団において、74例中64例(86.5%)に嘔吐、60例(81.1%)に下痢、57例(77.0%)に悪心、41例(55.4%)に口内炎が認められました。
- 国内第Ⅰ相試験において、12例中5例(41.7%)に下痢、4例(33.3%)に嘔吐、同じく4例(33.3%)に口内炎が認められました。
- 小児患者の併合集団において、重篤な有害事象は6例(8.1%)で、下痢2例等が認められましたが、いずれも転帰は回復でした。Grade3以上の有害事象は21例(28.4%)、投与中止に至った有害事象は3例(4.1%)、減量に至った有害事象は3例(4.1%)、休薬に至った有害事象は36例(48.6%)でした。
- 国内第Ⅰ相試験において、重篤な有害事象、Grade3以上の有害事象、投与中止、減量及び休薬に至った有害事象は認められませんでした。
臨床試験での処置1)4)
- 症状に応じて休薬・減量・投与中止の対応を行いました。
- 国内第Ⅰ相試験では、下痢の管理として食事管理や実施医療機関の手順に従い、止瀉剤であるロペラミドの服用が定められていました4)。食事管理では、BRAT食(バナナ・白米・アップルソース・トースト・プレーンパスタ)や易消化性食品を摂取し、乳糖含有製品、揚げ物、脂肪の多い又は辛い食品を回避し、水分摂取量を増加(水・コンソメスープ・塩分や糖分を含んだ液体等の透明な液体を1日コップ8~10杯)させる等が定められていました4)。
海外第Ⅰ相試験(SPRINT試験第Ⅰ相)の試験概要
- 【目的】
- NF1患者のPNに対するコセルゴ®の最大耐量、第Ⅱ相試験推奨用量、薬物動態、安全性、忍容性、及び有効性を検討すること
- 【対象】
- 組み入れ時に手術不能なPNを有する小児期のNF1患者24例
- 【方法】
- 標準的な3+3用量漸増デザインを用いて、コセルゴ®を3用量(20、25、30mg/m²[体表面積])について評価した。
コセルゴ®は1日2回(約12時間毎)を連日経口投与した。
- 【リミテーション】
- NF1患者に対して未検証のアウトカム指標が含まれている。
海外第Ⅱ相試験(SPRINT試験第Ⅱ相-1)の試験概要
- 【目的】
- NF1患者のPNに対する抗腫瘍効果及び臨床転帰から有効性を検討し、安全性についても検討すること
- 【対象】
- 組み入れ時にPN関連の病的状態を伴い、手術不能なPNを有する小児期のNF1患者50例
- 【方法】
- コセルゴ®25mg/m²(体表面積)1日2回(約12時間毎)を連日経口投与し、コセルゴ®の有効性・安全性を評価する。
- 【リミテーション】
- NF1患者に対して未検証のアウトカム指標が含まれている。
国内第Ⅰ相試験(D1346C00013試験)の試験概要
- 【目的】
- PN関連の病的状態を伴い、手術不能なPNを有する小児期の日本人NF1患者を対象にコセルゴ®の安全性、有効性、及び薬物動態について検討すること
- 【対象】
- PN関連の病的状態を伴い、手術不能なPNを有する小児期の日本人NF1患者12例
- 【方法】
- コセルゴ® 25mg/m²(体表面積)1日2回(約12時間毎)を連日経口投与し、コセルゴ®の有効性・安全性を評価する。
- 【リミテーション】
- 患者数が少ないため、まれな有害事象の検出率が限られていた可能性がある。フォローアップ期間が短期である。
第Ⅰ相試験であり、有効性は予備的な評価である。
- コセルゴ安全性マネジメントポケットガイド(2023年11月作成)p31, 32
- コセルゴ適正使用ガイド(2024年3月作成)p21
- 社内資料:注意を要する副作用とその対策(承認時評価資料)
- 社内資料:国内第Ⅰ相試験(D1346C00013)(承認時評価資料)

