コセルゴ®における注意事項、異常がみられた場合の対処方法1)
本剤の投与により、肝機能障害があらわれる場合があるので、次の事項に注意してください。
- 本剤投与中は定期的に肝機能検査を行ってください。
- 小児を対象とした臨床試験において、重篤な肝機能障害を引き起こす可能性のあるアスパラギン酸アミノトランスフェラーゼ(AST)やアラニンアミノトランスフェラーゼ(ALT)、ビリルビンの上昇が認められています。
- 既承認のMEK阻害剤において、AST及びALT等の上昇を伴う肝機能障害の発現が報告されています。
<異常がみられた場合の対処方法>
- 必要に応じて休薬、減量や投与中止等、適切な処置を行ってください。
- 厚生労働省のホームページに重篤副作用疾患別対応マニュアル「薬物性肝障害」が掲載されていますのでご参照ください。
https://www.mhlw.go.jp/topics/2006/11/tp1122-1i.html(2024/02/09確認)
- コセルゴ適正使用ガイド(2024年3月作成)p24
肝機能障害発現時の用量調節基準1)


- GradeはCTCAE ver.4.03に準じる
肝機能障害のGrade分類(一部)
AST増加のGrade分類(CTCAE v4.0 - JCOGより抜粋)2)
| Grade1 | Grade2 | Grade3 | Grade4 |
|---|---|---|---|
| >ULN-3.0×ULN | >3.0-5.0×ULN | >5.0-20.0×ULN | >20.0×ULN |
AST増加のGrade分類(CTCAE v5.0 - JCOGより抜粋)3)
| Grade1 | Grade2 | Grade3 | Grade4 |
|---|---|---|---|
| ベースラインが基準範囲内の場合>ULN-3.0×ULN;ベースラインが異常値の場合>1.5-3.0×ベースライン | ベースラインが基準範囲内の場合>3.0-5.0×ULN;ベースラインが異常値の場合>3.0-5.0×ベースライン | ベースラインが基準範囲内の場合>5.0-20.0×ULN;ベースラインが異常値の場合>5.0-20.0×ベースライン | ベースラインが基準範囲内の場合>20.0×ULN;ベースラインが異常値の場合>20.0×ベースライン |
ALT増加のGrade分類(CTCAE v4.0 - JCOGより抜粋)2)
| Grade1 | Grade2 | Grade3 | Grade4 |
|---|---|---|---|
| >ULN-3.0×ULN | >3.0-5.0×ULN | >5.0-20.0×ULN | >20.0×ULN |
ALT増加のGrade分類(CTCAE v5.0 - JCOGより抜粋)3)
| Grade1 | Grade2 | Grade3 | Grade4 |
|---|---|---|---|
| ベースラインが基準範囲内の場合>ULN-3.0×ULN;ベースラインが異常値の場合>1.5-3.0×ベースライン | ベースラインが基準範囲内の場合>3.0-5.0×ULN;ベースラインが異常値の場合>3.0-5.0×ベースライン | ベースラインが基準範囲内の場合>5.0-20.0×ULN;ベースラインが異常値の場合>5.0-20.0×ベースライン | ベースラインが基準範囲内の場合>20.0×ULN;ベースラインが異常値の場合>20.0×ベースライン |
血中ビリルビン増加のGrade分類(CTCAE v4.0 - JCOGより抜粋)2)
| Grade1 | Grade2 | Grade3 | Grade4 |
|---|---|---|---|
| >ULN-1.5×ULN | >1.5-3.0×ULN | >3.0-10.0×ULN | >10.0×ULN |
血中ビリルビン増加のGrade分類(CTCAE v5.0 - JCOGより抜粋)3)
| Grade1 | Grade2 | Grade3 | Grade4 |
|---|---|---|---|
| ベースラインが基準範囲内の場合>ULN-1.5×ULN;ベースラインが異常値の場合1.0-1.5×ベースライン | ベースラインが基準範囲内の場合>1.5-3.0×ULN;ベースラインが異常値の場合>1.5-3.0×ベースライン | ベースラインが基準範囲内の場合>3.0-10.0×ULN;ベースラインが異常値の場合>3.0-10.0×ベースライン | ベースラインが基準範囲内の場合>10.0×ULN;ベースラインが異常値の場合>10.0×ベースライン |
- コセルゴ電子添文2023年12月改訂(第3版)
- JCOGホームページ: Common Terminology Criteria for Adverse Events(CTCAE)Version 4.0, https://jcog.jp/assets/CTCAEv4J_20170912_v20_1.pdf, 2024/08/06確認
- JCOGホームページ: Common Terminology Criteria for Adverse Events(CTCAE)Version 5.0, https://jcog.jp/assets/CTCAEv5J_20220901_v25_1.pdf, 2024/08/06確認
臨床試験での初回発現時期
海外第Ⅱ相試験におけるAST増加、ALT増加、血中ビリルビン増加の初回発現時期は図の通りでした(海外データ)1)。
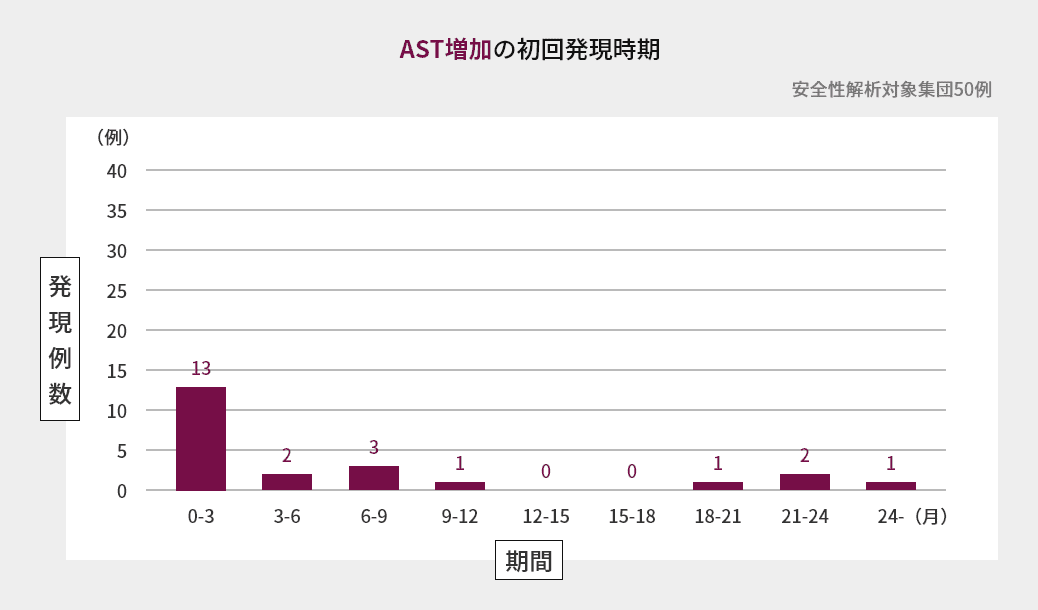
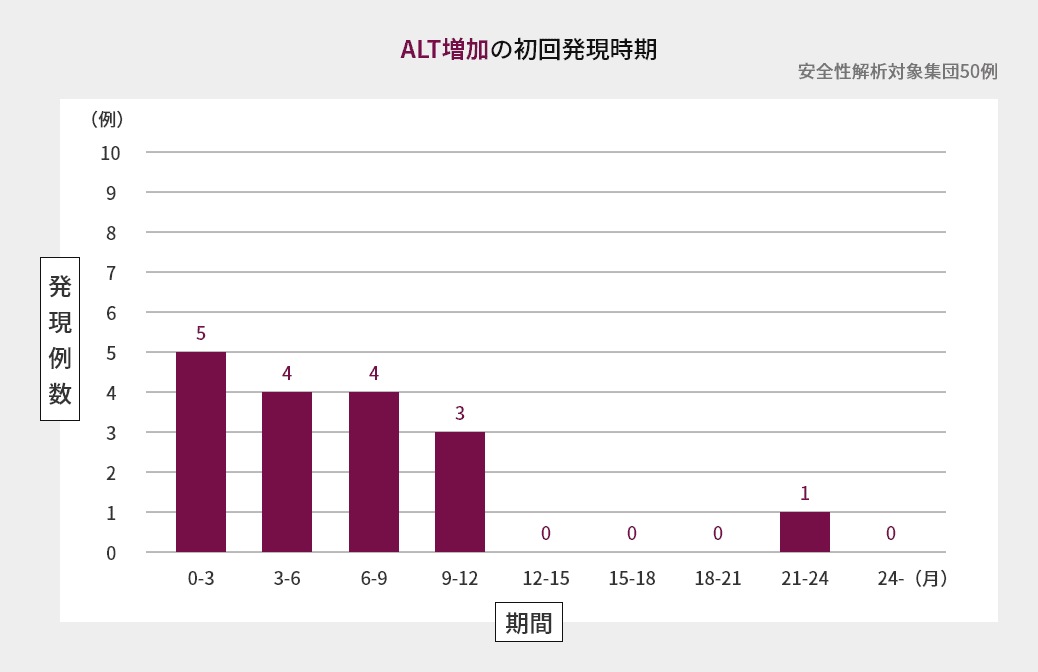
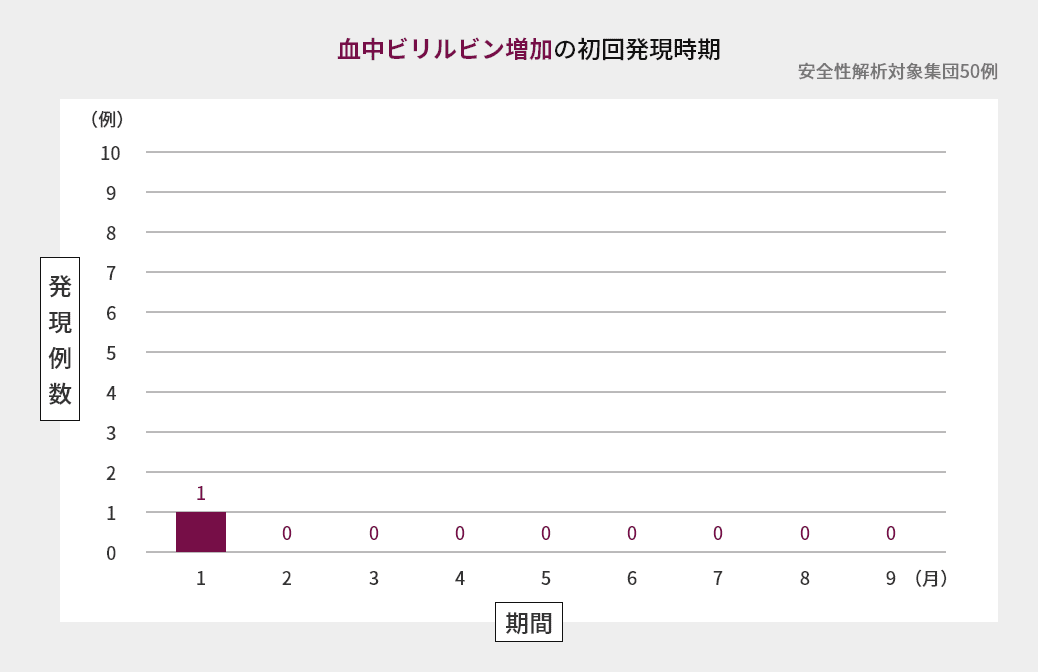
臨床試験での発現状況(海外データを含む)2)3)
臨床試験での有害事象の発現状況(海外第Ⅱ相試験、国内第Ⅰ相試験、海外第Ⅰ相試験群と海外第Ⅱ相試験群の併合集団)
- 海外第Ⅱ相試験、国内第Ⅰ相試験、及び小児患者の併合集団において、本剤が投与された患者における肝機能障害の発現状況は以下の通りでした。
| 試験 | 全Grade 例(%) |
Grade3以上 例(%) |
||||
|---|---|---|---|---|---|---|
| AST 増加 |
ALT 増加 |
血中ビリルビン 増加 |
AST 増加 |
ALT 増加 |
血中ビリルビン 増加 |
|
| 海外第Ⅱ相試験 50例 |
23 (46.0) |
19 (38.0) |
1 (2.0) |
1 (2.0) |
2 (4.0) |
0 (0.0) |
| 国内第Ⅰ相試験 12例 |
1 (8.3) |
0 (0.0) |
0 (0.0) |
0 (0.0) |
0 (0.0) |
0 (0.0) |
| 小児患者の併合集団 (海外第Ⅰ相試験群+海外第Ⅱ相試験群)74例 |
38 (51.4) |
29 (39.2) |
5 (6.8) |
1 (1.4) |
2 (2.7) |
0 (0.0) |
Gradeは海外第Ⅰ相試験及び海外第Ⅱ相試験ではCTCAE ver.4.0に、国内第Ⅰ相試験ではCTCAE ver.5.0に準じる。
- 小児患者の併合集団においてGrade3以上の有害事象は、AST増加、AST増加/ALT増加の各1例(1.4%)に認められ、Grade4以上の有害事象は認められませんでした。減量又は休薬に至った有害事象はAST/ALT増加の各1例でした。
- 国内第Ⅰ相試験において、Grade3以上の有害事象、投与中止に至った有害事象、減量又は休薬に至った有害事象は認められませんでした。
海外第Ⅰ相試験(SPRINT試験第Ⅰ相)の試験概要
- 【目的】
- NF1患者のPNに対するコセルゴ®の最大耐量、第Ⅱ相試験推奨用量、薬物動態、安全性、忍容性、及び有効性を検討すること
- 【対象】
- 組み入れ時に手術不能なPNを有する小児期のNF1患者24例
- 【方法】
- 標準的な3+3用量漸増デザインを用いて、コセルゴ®を3用量(20、25、30mg/m²[体表面積])について評価した。
コセルゴ®は1日2回(約12時間毎)を連日経口投与した。
- 【リミテーション】
- NF1患者に対して未検証のアウトカム指標が含まれている。
海外第Ⅱ相試験(SPRINT試験第Ⅱ相-1)の試験概要
- 【目的】
- NF1患者のPNに対する抗腫瘍効果及び臨床転帰から有効性を検討し、安全性についても検討すること
- 【対象】
- 組み入れ時にPN関連の病的状態を伴い、手術不能なPNを有する小児期のNF1患者50例
- 【方法】
- コセルゴ®25mg/m²(体表面積)1日2回(約12時間毎)を連日経口投与し、コセルゴ®の有効性・安全性を評価する。
- 【リミテーション】
- NF1患者に対して未検証のアウトカム指標が含まれている。
国内第Ⅰ相試験(D1346C00013試験)の試験概要
- 【目的】
- PN関連の病的状態を伴い、手術不能なPNを有する小児期の日本人NF1患者を対象にコセルゴ®の安全性、有効性、及び薬物動態について検討すること
- 【対象】
- PN関連の病的状態を伴い、手術不能なPNを有する小児期の日本人NF1患者12例
- 【方法】
- コセルゴ® 25mg/m²(体表面積)1日2回(約12時間毎)を連日経口投与し、コセルゴ®の有効性・安全性を評価する。
- 【リミテーション】
- 患者数が少ないため、まれな有害事象の検出率が限られていた可能性がある。フォローアップ期間が短期である。
第Ⅰ相試験であり、有効性は予備的な評価である。
- コセルゴ安全性マネジメントポケットガイド(2023年11月作成)p34, 35
- コセルゴ適正使用ガイド(2024年3月作成)p24
- 社内資料:注意を要する副作用とその対策(承認時評価資料)

